
คำนวณความเข้มข้นของสารละลาย และการเตรียมสารละลาย
แบบฝึกหัด
EASY
คำนวณความเข้มข้นของสารละลาย และการเตรียมสารละลาย
MEDIUM
คำนวณความเข้มข้นของสารละลาย และการเตรียมสารละลาย
HARD
คำนวณความเข้มข้นของสารละลาย และการเตรียมสารละลาย
เนื้อหา
สารละลาย
ความเข้มข้นของสารละลาย
ประกอบด้วย องค์ประกอบสองชนิด คือ
- ตัวทำละลาย (solvent) มีสถานะเป็นของเหลว
- ตัวถูกละลาย (solute) มีสถานะได้ทั้งของเหลว และของแข็ง
ในกรณีที่สารละลายเกิดจากการผสมกันของของเหลวตั้งแต่สองชนิดขึ้นไป ของเหลวที่มีปริมาณมากกว่าจะเป็นตัวทำละลาย
ดังนั้น เพื่อให้สามารถบอกได้ว่าสารละลายแต่ละชนิดมีองค์ประกอบของตัวถูกละลายในสารละลายทั้งหมดปริมาณเท่าไหร่
จึงได้มีการกำหนดหน่วยของความเข้มข้นขึ้นดังนี้
1. ร้อยละ หรือส่วนในร้อย (percent; %)
- ร้อยละโดยมวล (w/w) หมายถึง มวลของตัวถูกละลายในสารละลาย 100 หน่วยมวลเดียวกัน

- ร้อยละโดยปริมาตร (v/v) หมายถึง ปริมาตรของตัวถูกละลายในสารละลาย 100 หน่วยปริมาตรเดียวกัน
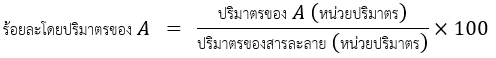
- ร้อยละโดยมวลต่อปริมาตร (w/v) หมายถึง มวลของตัวถูกละลายในสารละลาย 100 หน่วยปริมาตร ในหน่วยของ g/ml หรือ kg/L

2. ส่วนในล้านส่วน (parts per million; ppm) หรือ ส่วนในพันล้านส่วน (parts per billion; ppb)
หมายถึง ปริมาณตัวถูกละลายเป็นมวลหรือปริมาตร 1 ส่วน ในสารละลาย 1 ล้านส่วน หรือในใน 1 พันล้านส่วน ตามลำดับ

หมายเหตุ ในแต่ละสูตรการคำนวณ มวล หรือ ปริมาตรของตัวถูกละลาย และของสารละลาย จะต้องอยู่ในหน่วยเดียวกัน
3. โมลาริตี (Molarity)
หรือ เรียกเป็นความเข้มข้นว่า “โมลาร์” (Molar; M) หมายถึง จำนวนโมลของตัวถูกละลายในสารละลาย 1 ลิตร จึงมีหน่วยเป็น โมล/ลิตร
4. โมแลลิตี (Molality)
หรือ เรียกเป็นความเข้มข้นว่า “โมลแลล” (Molal; m) หมายถึง จำนวนโมลของตัวถูกละลายในตัวทำละลาย 1 กิโลกรัม จึงมีหน่วยเป็น โมล/กิโลกรัม

การเตรียมสารละลาย
แต่อย่างไรก็ตามจำนวนโมลสารของตัวถูกละลายจะเท่ากันในสภาวะที่สารยังไม่เจือจาง หรือถูกเจือจางแล้วก็ตาม

ดังนั้น จะได้ว่า M1V1 = M2V2
สมบัติคอลลิเกตีฟของสารละลาย
โดย จุดเดือดหรือจุดหลอมเหลวที่เปลี่ยนแปลงไปของสารละลาย เมื่อเที่ยบกับตัวทำละลายบริสุทธ์ จะขึ้นอยู่กับความเข้มข้นของสารละลายในหน่วยโมแลล (โมล/กิโลกรัม) เท่านั้น ถ้าสารนั้นๆแตกตัวได้จะต้องคิดจำนวนโมลรวมของไอออนแต่ละชนิดด้วย

Tb = จุดเดือดของสารละลาย – จุดเดือดของตัวทำละลาย (°C)
i = van’t Hoff factor แสดงถึง จำนวนอนุภาคที่เกิดจากการแตกตัวของสาร
(ดังนั้น สารที่ไม่แตกตัวในตัวทำละลายจะมีค่า i = 1 เช่น กลูโคส, เมทานอล ส่วนสารที่แตกตัวในน้ำ
เช่น NaCl ® Na+(aq) + Cl- (aq) จะมีค่า i = 2 เนื่องจาก NaCl แตกตัวให้สองอนุภาค คือ Na+ และ Cl-)
Kb = ค่าคงที่ของการเพิ่มขึ้นของจุดเดือดของสารละลาย (°C/mol/kg)
m = ความเข้นข้นของสารละลายในหน่วยโมแลล (mol/kg)
m1 = มวลของตัวถูกละลาย (g)
m2 = มวลของตัวทำละลาย (g)
MW1 = มวลโมเลกุลของตัวถูกละลาย