การแตกตัวหรือความแรงของกรดและเบส
แบบฝึกหัด
EASY
การแตกตัวหรือความแรงของกรดและเบส
MEDIUM
การแตกตัวหรือความแรงของกรดและเบส
HARD
การแตกตัวหรือความแรงของกรดและเบส
เนื้อหา
การแตกตัวหรือความแรงของกรดและเบส
โดยสารละลายอิเล็กโตรไลต์สามารถแบ่งออกเป็น 2 ประเภทใหญ่ๆ คือ
- สารละลายอิเล็กโตรไลต์แก่
- สารละลายอิเล็กโตรไลต์อ่อน
- สารละลายกรดแก่และเบสแก่ จัดเป็น สารละลายอิเล็กโตรไลต์แก่
- สารละลายกรดอ่อนและเบสอ่อน จัดเป็น สารละลายอิเล็กโตรไลต์อ่อน
การแตกตัวของกรดแก่และเบสแก่
สารละลายกรดแก่และเบสแก่ จัดเป็น สารละลายอิเล็กโตรไลต์แก่ เนื่องจากกรดแก่และเบสแก่สามารถแตกตัวเป็นไอออนได้สมบูรณ์ เกิดปฏิกิริยาไปข้างหน้าเพียงอย่างเดียว ไม่เหลือโมเลกุลของกรดแก่ หรือ เบสแก่ในระบบอีกเลย
ดังนั้น ถ้าทราบความเข้มข้นของกรดแก่หรือเบสแก่ ก็สามารถคำนวณหาความเข้มข้นของไฮโดรเนียมไอออน (H3O+) และไฮดรอกไซด์ไอออน (OH-) ได้ ดังสมการ (1) แสดงการแตกตัวของกรดแก่ไนตริก (HNO3)
จากสมการ (1) ซึ่งเป็นสมการเคมีสมดุลแล้ว จึงทราบอัตราส่วนจำนวนโมลของสารทุกชนิดในปฏิกิริยา
ดังนั้น ถ้าสารละลายกรด HNO3 มีความเข้มข้น 1 โมลาร์ ก็จะพบว่าในสารละลายมี H3O+ ไอออน และ NO3- ไอออน มีความเข้มข้น 1 โมลาร์ เช่นกัน
เมื่อพิจารณาการแตกตัวของเบสแก่ Ba(OH)2 เมื่อละลายเกลือในน้ำ และได้สารละลายมีความเข้มข้น 1 โมลาร์ ดังสมการ (2)
จากสมการ (2) ซึ่งเป็นสมการเคมีสมดุลแล้ว ถ้าสารละลายเบส Ba(OH)2 มีความเข้มข้น 1 โมลาร์ ก็จะมีพบว่าในสารละลายมี Ba2+เข้มข้น 1 โมลาร์ ส่วน OH- ไอออน มีความเข้มข้น 2 โมลาร์ ตามอัตราส่วนจำนวนโมลในการสมดุลสมการเคมี
การแตกตัวของกรดอ่อนและเบสอ่อน
สารละลายกรดอ่อนและเบสอ่อน จัดเป็น สารละลายอิเล็กโตรไลต์อ่อนเนื่องจากกรดอ่อนและเบสอ่อน แตกตัวเป็นไอออนได้เพียงบางส่วน เหลือโมเลกุลของกรดอ่อนหรือเบสอ่อน ผสมอยู่ในสารละลาย ปฏิกิริยาการแตกตัวของกรดอ่อน/เบสอ่อนเป็นปฏิกิริยาย้อนกลับได้ เกิดสภาวะสมดุล
ดังนั้น ณ ภาวะสมดุลจึงมีทั้งโมเลกุลของกรด/เบส และไอออนที่ได้จากการแตกตัว
ตัวอย่างเช่น การแตกตัวของกรดอ่อน HA ที่แตกตัวได้เพียงร้อยละ 5
ดังนั้น หากกรดอ่อน HA มีความเข้มข้นเริ่มต้น 1 โมลาร์ แล้วเกิดการแตกตัวได้ร้อยละ 5
หมายความว่า ในสารละลายปริมาตร 1 ลิตร เริ่มต้นมีกรด HA ละลายอยู่ 1 โมล เมื่อกรด HA แตกตัวเป็น H3O+ ไอออน และ A- ไอออน จนถึงภาวะสมดุล จะพบว่ามี H3O+ ไอออน และ A- ไอออน อยู่ในสารละลายอย่างละ 0.05 โมล และมีกรด HA อยู่ 0.95 โมล
การเปรียบเทียบว่ากรดอ่อนชนิดใดแตกตัวได้ดีกว่ากัน
ต้องพิจารณาที่ค่าคงที่สมดุล (Ka) กรดชนิดใดมีค่า Ka สูงกว่า แสดงว่าสามารถแตกตัวได้มากกว่า การคำนวณหาค่า Ka ต้องหาจากสมการสมดุลของกรด HA
แสดงได้ดังนี้
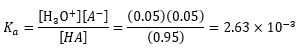
กรณี ที่กรดอ่อนที่สามารถแตกตัวได้มากกว่า 1 ขั้น เช่น H2A สามารถแตกตัวได้ 2 ขั้น จึงมีค่า Ka1 และ Ka2 ในแต่ละขั้นจะแตกตัวให้ H+ 1 โมล
ดังนี้ คือ
ขั้นที่ 1 ได้ว่า
![]()
ดังนั้น

ขั้นที่ 2 ได้ว่า
![]()
ดังนั้น
![]()
ในทำนองเดียวกัน H3A สามารถแตกตัวได้ 3 ขั้น จึงมีค่า Ka1 Ka2 และ Ka3
โดยปกติค่า Ka1 > Ka2 > Ka3
การแตกตัวของเบสอ่อนพิจารณาได้ในทำนองเดียวกับกรดอ่อน
ตัวอย่างเช่น สารละลายเบสอ่อน XOH เข้มข้น 0.20 โมลาร์ แตกตัวให้ร้อยละ 5 สมการสมดุลของการแตกตัวของเบส XOH แสดงดังสมการ (4)
แสดงว่าในสารละลายปริมาตร 1 ลิตร เริ่มต้นมีเบส XOH ละลายอยู่ 0.20 โมล เมื่อเบส XOH แตกตัวเป็น X+ ไอออน และ OH- ไอออน จนถึงภาวะสมดุล จะพบว่ามี X+ ไอออน และ OH- ไอออน อยู่ในสารละลายอย่างละ 0.01 โมล และมีเบส XOH อยู่ 0.19 โมล
![]()
กรณี เบสอ่อนที่สามารถแตกตัวได้มากกว่า 1 ขั้น เช่น X(OH)2 สามารถแตกตัวได้ 2 ขั้น จึงมีค่า Kb1 และ Kb2 ในแต่ละขั้นจะแตกตัวให้ OH- 1 โมล
กรณี เบส X(OH)3 สามารถแตกตัวได้ 3 ขั้น จึงมีค่า Kb1 Kb2 และ Kb3
และเช่นเดียวกันค่า Kb1 > Kb2 > Kb3