ทดลองและอธิบายผลของตัวแปรที่มีต่ออัตราการเกิดปฏิกิริยา
แบบฝึกหัด
EASY
ทดลองและอธิบายผลของตัวแปรที่มีต่ออัตราการเกิดปฏิกิริยา
MEDIUM
ทดลองและอธิบายผลของตัวแปรที่มีต่ออัตราการเกิดปฏิกิริยา
HARD
ทดลองและอธิบายผลของตัวแปรที่มีต่ออัตราการเกิดปฏิกิริยา
เนื้อหา
ผลของความเข้มข้น พื้นที่ผิวของสารตั้งต้น อุณหภูมิ และตัวเร่งปฏิกิริยาที่มีต่ออัตราการเกิดปฏิกิริยา
ทฤษฎีการชน
กล่าวว่า
ดังนั้น จำนวนครั้งของการชนจึงส่งผลต่ออัตราการเกิดปฏิกิริยา ยิ่งมีสารตั้งต้นปริมาณมาก จำนวนครั้งของการชนก็ยิ่งมาก แสดงว่า ปริมาณของสารตั้งต้น หรือ ความเข้มข้นของสารตั้งต้นมาก ย่อมให้เกิดจำนวนครั้งของการชนที่มีพลังงานมากพอเพื่อให้เกิดปฏิกิริยายิ่งมาก ทำให้อัตราการเกิดปฏิกิริยาเคมีเร็ว
ดังเช่น
ปฏิกิริยาระหว่างสารละลายโซเดียมไทโอซัลเฟต กับสารละลายกรดไฮโดรคลอริก
แสดงดังสมการ (1)
ความเข้มข้นของสารละลายทั้งสองมีผลต่ออัตราการเกิดปฏิกิริยา กล่าวคือ เมื่อความเข้มข้นของสารละลายทั้งสองเพิ่มมากขึ้น จะทำให้อัตราเร็วของการเกิดปฏิกิริยาเร็วมากขึ้นตามลำดับ แสดงได้จากเวลาที่บันทึกตั้งแต่เริ่มเกิดปฏิกิริยาจนกระทั่งมองไม่เห็นรอยขีดกากบาทบนกระดาษ มีค่าน้อยลงเป็นลำดับ
เช่น สารที่เป็นของแข็ง ทำปฏิกิริยากับสารที่เป็นของเหลว ปฏิกิริยาจึงเกิดขึ้นที่พื้นที่ผิวของของแข็ง
ดังนั้น หากมีพื้นที่ผิวมาก โอกาสที่จะทำให้เกิดการชนยิ่งมีมาก หรือกล่าวได้ว่า พื้นที่ผิวมาก จะเกิดปฏิกิริยาได้เร็ว
ดังเช่น
ปฏิกิริยาระหว่างลวดแมกนีเซียมกับสารละลายกรดไฮโดรคลอริก สมการเคมีที่สมดุลแล้ว แสดงดังสมการ (2)
จากผลการทดลองพบว่าลวดแมกนีเซียมที่ถูกพับไว้ จะเกิดแก๊สไฮโดรเจนขึ้นน้อยกว่า ลวดแมกนีเซียมที่ไม่ได้ถูกพับ นั่นแสดงให้เห็นว่า พื้นที่ผิวของสารมีผลต่ออัตราการเกิดปฏิกิริยาเคมี
เช่น
ปฏิกิริยาระหว่างกรดออกซาลิกกับสารละลายโพแทสเซียมเปอร์แมงกาเนต
แสดงดังสมการ (3)
หากไม่ให้ความร้อนกับสารละลายกรดออกซาลิกก่อนนำไปเติมสารละลายโพแทสเซียมเปอร์แมงกาเนต จะไม่เกิดปฏิกิริยา
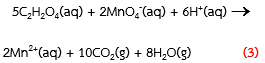
การกระจายพลังงานจลน์ของโมเลกุลแก๊สที่อุณหภูมิต่างๆ แสดงในรูปที่ 1 ที่อุณหภูมิสูง T2 จำนวนโมเลกุลที่มีพลังงานสูงกว่าพลังงานก่อกัมมันต์มีมากกว่าที่อุณหภูมิต่ำ T1 (โดยพิจารณาได้จากพื้นที่ใต้กราฟของแต่ละอุณหภูมิ) แสดงว่าที่อุณหภูมิสูงการชนกันของสารตั้งต้นมีโอกาสที่จะเกิดการเปลี่ยนแปลงไปเป็นผลิตภัณฑ์มากกว่าที่อุณหภูมิต่ำ

รูปที่ 1 การกระจายพลังงานจลน์ชองโมเลกุลแก๊สที่อุณหภูมิต่างกัน
เช่น
การสลายตัวของสารละลายไฮโดรเจนเปอร์ออกไซด์ ให้น้ำและแก๊สออกซิเจน
แสดงดังสมการ (4)
แต่ถ้าเติมโพแทสเซียมไอโอไดด์ลงไปเล็กน้อย จะทำให้เกิดปฏิกิริยาได้อย่างรวดเร็ว
โดยตัวเร่งปฏิกิริยาจะเข้ารวมตัวกับสารตั้งต้นเกิดเป็นสารเชิงซ้อนก่อกัมมันต์ที่มีพลังงานกระตุ้นต่ำกว่าเดิม ดังรูปที่ 2 จึงทำให้อนุภาคที่ชนกันแล้วมีพลังงานมากกว่าพลังงานก่อกัมมันต์มีมาก จึงทำให้เกิดปฏิกิริยาได้เร็วขึ้น โดยเมื่อเสร็จสิ้นปฏิกิริยาตัวเร่งปฏิกิริยาจะกลับคืนมาด้วยปริมาณเท่าเดิม
ในทางตรงกันข้าม บางกรณีเราเติมสารบางชนิดปริมาณเล็กน้อยลงในปฏิกิริยา เพื่อทำให้ปฏิกิริยาเกิดช้าลง เราเรียกสารนั้นว่า “ตัวหน่วงปฏิกิริยา”
เช่น
การเติมผงโซเดียมฟลูออไรด์ลงผสมกับเปลือกไข่ แล้วเติมกรดอะซีติก จะทำให้อัตราการทำปฏิกิริยาของเปลือกไข่กับกรดอะซีติกช้าลง
แสดงดังสมการ (5)


รูปที่ 2 ผลของตัวเร่งปฏิกิริยาต่ออัตราการเกิดปฏิกิริยาเคมี